Criterios y estándares de aprendizaje del bloque II
Antes de nada, recordar (de 3º de ESO) cómo podemos clasificar la materia . Os dejo un esquema de clasificación de los sistemas materiales.
Las leyes ponderales son aquellas que rigen el comportamiento de la materia en los cambios químicos, en función de la masa de las sustancias que participan. Hay 3 leyes ponderales:
* Ley de Lavoisier o de conservación de la masa.
* Ley de Proust o de las proporciones constantes.
* Ley de Dalton o de las proporciones múltiples.
Recordemos en primer lugar la Ley de Lavoisier.
Aquí tenéis una muy buena página para entender mejor la ley de las proporciones constantes ( L. de Proust) :
Puedes ver cómo realizar la experiencia en este vídeo del IES Valle del Saja:
Ahora puedes ver la explicación teórica que Dalton dio tanto a la ley de conservación de la masa como a la de las proporciones definidas.
Dalton en 1803 enunció la ley de las proporciones múltiples . En el siguiente esquema puedes ver un ejemplo. También tienes el siguiente vídeo:
Repasa las leyes ponderales con el siguiente vídeo:
Veamos ahora una ley que hace referencia a los volúmenes de gases que intervienen en una reacción. La enunció Gay-Lussac que en realidad la intuyó, más que verificarla experimentalmente, debido a la poca precisión de los instrumentos de los que disponía. Se conoce como ley de los volúmenes de combinación .
La hipótesis de Avogadro fue formulada en 1811 y relaciona el nº de partículas (moléculas) con el volumen que ocupa un gas como puedes ver aquí también. Esta hipótesis permitía interpretar la ley de los volúmenes de combinación :
Aplicando dicha hipótesis podemos determinar experimentalmente masas atómicas relativas de diferentes gases:
Puedes repasar lo visto hasta ahora aquí.
Para recordar y practicar el concepto de mol y su relación con la masa , el número de moléculas (o átomos) o el volumen (gases) de un sistema material puedes usar los siguientes enlaces ya utilizados en cursos anteriores:
Conceptos básicos:
El siguiente laboratorio virtual de Salvador Hurtado te puede ayudar a afianzar los conceptos anteriores:
Aquí tienes otra simulación para entender el concepto de mol y después resolver las actividades planteadas:
Ejercicios nivel inicial (paso a paso, 3º ESO)
Ejercicios nivel 4º ESO
Test (3º ESO)
Recordemos un poco acerca del comportamiento de los gases y las leyes que rigen su comportamiento.
Leyes de los gases:
A) Ley de Boyle-Mariotte. ( T = cte)
B) Ley de Charles ( p =cte)
C) Ley de Gay-Lussac ( V=cte)
Las tres leyes anteriores se pueden globalizar en una sola ecuación denominada ley combinada de los gases ideales:
La ecuación anterior adquiere un especial interés cuando consideramos 1 mol de sustancia gaseosa. En ella, el cociente pV/T alcanza un valor conocido como constante molar de los gases (R).
El siguiente applet tiene como objetivo deducir el valor de la constante «R» :
La relación anterior da lugar a la llamada ecuación de los gases ideales en función de la cantidad de sustancia:
p V = n R T
Todo lo anterior se recoge en el siguiente vídeo:
Puedes experimentar virtualmente con gases en la siguiente simulación:
Debemos tener en cuenta que los gases ideales no existen en la naturaleza y por ello Van Der Waals modificó la ecuación de los gases ideales incluyendo unos términos correctivos, a (relacionada con la fuerza de atracción entre partículas) y b (relacionada con su tamaño), conocidas como constantes de Van der Waals, que dependen de la sustancia que se esté estudiando en cada caso.

Diversos experimentos muestran que los gases se acercan al comportamiento ideal sólo a bajas presiones (≤ 5 atm) y temperaturas moderadas ya que en ese caso los términos correctivos pueden despreciarse y obtenemos la ecuación de los gases ideales.
Una última ley que hace referencia a los gases es la ley de las presiones parciales que también fue deducida por Dalton :
Para repasar todo lo anterior, visita esta web.
Veamos ahora cómo determinar la fórmula empírica y fórmula molecular de un compuesto:
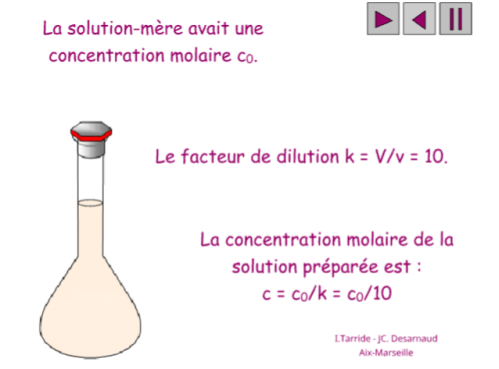
También es necesario conocer las diferentes formas de expresar la concentración de una disolución. Haremos especial hincapié en el concepto de molaridad:
Haz uso de las siguientes simulaciones para ver cómo se prepara una disolución en el laboratorio.Para algunas de ellas conviene usar Mozilla Firefox con la extensión Flash Player 2021:
PROPIEDADES COLIGATIVAS
Se llaman propiedades coligativas a aquellas que sólo dependen del número de partículas de soluto presentes en una disolución pero no de su naturaleza química. Son las siguientes:
* Descenso de la presión de vapor.
* Ascenso ebulloscópico (aumento del punto de ebullición).
* Descenso crioscópico (disminución del punto de congelación).
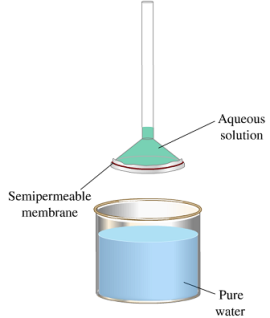
* Presión osmótica.
Las leyes que las rigen sólo se cumplen con exactitud para disoluciones ideales ( muy diluidas y con solutos no iónicos).
Puedes utilizar las siguientes simulaciones para estudiar el concepto de presión de vapor y las propiedades coligativas:
Si quieres saber por qué en invierno se echa sal en las carreteras puedes consultar en los siguientes enlaces:
Muy Interesante ; Scientia blog; Simple + mente física.
Os dejo las relaciones de actividades de este bloque que iremos haciendo en clase:
Ficha 1: Leyes ponderales y volumétricas.
Ficha 1b: Repaso leyes ponderales y volumétricas.
Ficha 2 : MOL
Repaso concepto de mol.
Ficha 3: Leyes de los gases.
Ficha 4: Fórmula empírica y molecular.
Ficha 4b. Repaso fórmula empírica y molecular.
Ficha 5. Disoluciones.
Ficha 5b. Repaso disoluciones.