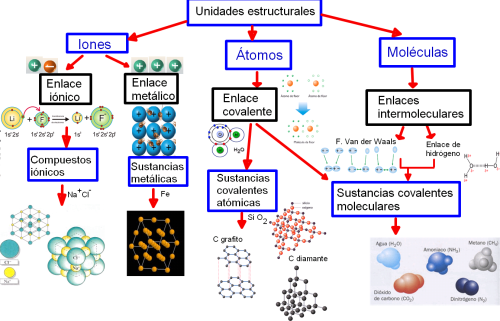
Contenidos,criterios de evaluación y estándares de evaluación
Empecemos recordando la relación entre enlace y estabilidad energética:
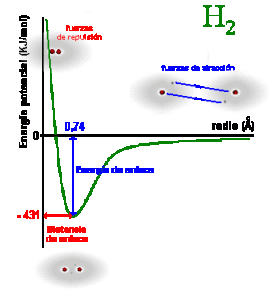
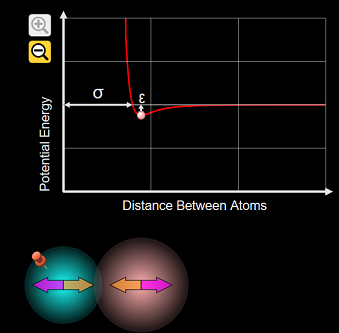
Entiéndelo un poco mejor con la siguiente animación. Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados y esto permite que puedan existir en la naturaleza. A esa situación más estable le corresponde un mínimo de energía denominada energía de enlace y una distancia entre átomos llamada distancia de enlace.
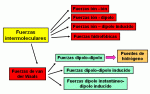
Recuerda lo básico de los tres tipos de enlaces:
Los vídeos de Vodpod ya no están disponibles.
A) ENLACE IÓNICO
Recordemos el enlace iónico. Mira la siguiente simulación de la formación del cloruro de sodio.
Más detalladamente, podemos ver todo lo relacionado con el enlace iónico en esta magnífica web.
Nos interesa conocer el balance energético en la formación de un compuesto iónico. Lo haremos mediante el ciclo de Born-Haber. A continuación lo podéis ver en esta simulación flash .
Aquí puedes ver varios ejemplos concretos.
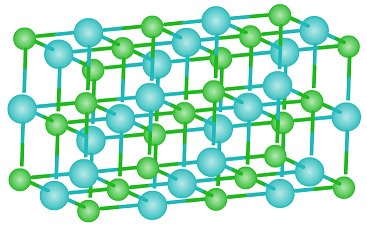
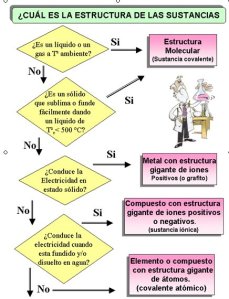
Los compuestos iónicos forman redes cristalinas cuyos principales tipos son:
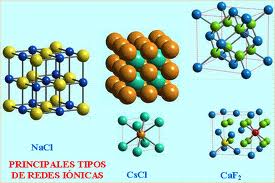
Debes conocer las principales propiedades de las sutancias iónicas. También puedes verlo aquí.
B) ENLACE COVALENTE.
Veamos ahora como se unen los átomos mediante enlace covalente:
Los vídeos de Vodpod ya no están disponibles.
Debes saber escribir la estructura de Lewis cuyas leyes de aplicación se pueden resumir:
Respondiendo a las preguntas planteadas para cada molécula puedes encontrar la estructura de Lewis correcta:
En esta web (in english) lo puedes encontrar más detallado y en esta otra puedes practicar un poco. Para comprobar que has escrito correctamente una estructura puedes utilizar la siguiente web
Puedes usar la siguiente aplicación interactiva para construir estructuras de Lewis.
También debes tener claro los conceptos de resonancia y de polaridad del enlace y de las moléculas. La siguiente simulación te muestra varios ejemplos:
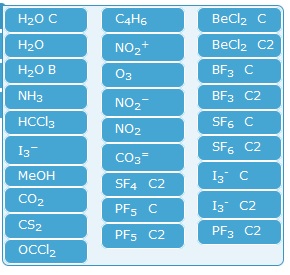
Determina la polaridad de las siguientes moléculas.
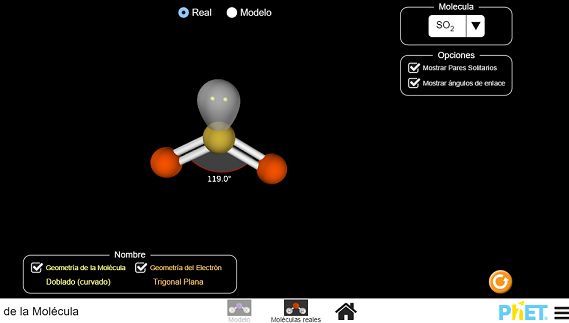
Para conocer la geometría de las moléculas podemos usar la teoría de repulsión de los pares de electrones de la capa de valencia (TRPECV). En el siguiente vídeo puedes visualizar la repulsión de pares de electrones usando globos.
Las diferentes geometrías según la TRPECV están indicadas en:
enlace 1 , enlace 2 , enlace 3 y enlace 4
Ya estás capacitado para resolver la siguiente actividad. Puedes ver actividades resueltas en el este documento de Lidia Iñigo.
Veamos ahora la Teoría de enlace-valencia (TEV)
Estudiemos más detenidamente los diferentes tipos de orbitales híbridos . Lo puedes ver también en esta animación o en los siguientes videos: