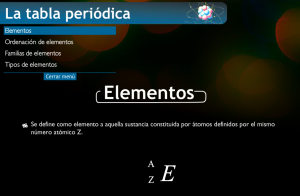
Empezamos recordando que un elemento químico es un conjunto de átomos de la misma clase. Actualmente se conocen 118 elementos.
Veamos ahora como se llega a clasificar los elementos tal y como están en la tabla periódica actual.Una primera clasificación de los elementos puede ser dividirlos en metales y no metales. Otras clasificaciones han sido las siguientes. Aquí se muestra un vídeo con la evolución de la tabla periódica:
Estudiemos los aspectos básicos de la tabla periódica que debemos conocer : enlace 1, enlace 2 y enlace 3 .
Un estupendo resumen lo tienes en la siguiente presentación:
Debes conocer los elementos representativos . Si quieres puedes probar con una canción como la que sigue:
Si eres más rockero, puedes intentarlo así :
Y por último tienes este rap de alumnos del profesor Alberto Gómez:
Bueno, mejor probamos de otra manera …
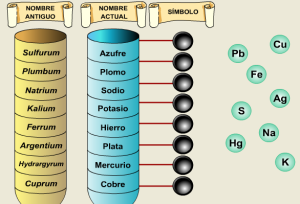
Primero familiarizate con nombres y los símbolos :
Coloca cada elemento en su grupo:
 https://learningapps.org/watch?v=p4pe3tugk20
https://learningapps.org/watch?v=p4pe3tugk20
Repasa grupo por grupo con ayuda de este test :
Ahora demuestra tus conocimientos sobre nombres y símbolos de los elementos en:
Para repasar dónde están situados los elementos en la tabla periódica te vendrá bien este puzzle o el siguiente juego basado en el tetris:
Este juego te pone a prueba:
O este otro :
Con la siguiente Tabla periódica interactiva puedes hacer ejercicios para practicar nombres, símbolos y configuración electrónica:
Para el siguiente juego se necesita un poco más de nivel…
También podéis practicar con el móvil si os descargáis las siguientes aplicaciones:
Has comprobado que jugando también puedes aprender.Para recordar los símbolos de los elementos químicos quizás te inspiren alguno de los siguientes juegos de palabras.
Repasa un poco en la siguiente web y en esta tabla interactiva que te da mucha información:
A continuación puedes comprobar si sabes la posición de los elementos en la Tabla Periódica:
.
A estas alturas este test de elementos químicos será pan comido.Por último puedes atreverte con la siguiente tabla muda o con el juego de «Pasa palabra» :
Para terminar y si tienes un poco de curiosidad puedes aprender algo más acerca de los metales alcalinos o sobre cualquier otro elemento consultando los videos que aparecen en «the periodic table of videos». También puedes obtener información sobre cada elemento en :
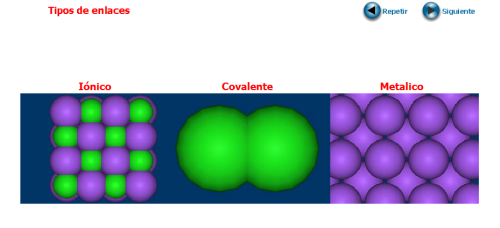
UNIONES ENTRE ÁTOMOS. ENLACE QUÍMICO
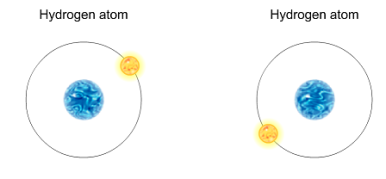
Generalmente los átomos libres tienen, por separado, una estabilidad menor que cuando están combinados. Para alcanzar una estabilidad mayor, los átomos pueden ir aproximándose ganando, perdiendo o compartiendo electrones de las capas externas hasta conseguir la configuración propia de un gas noble. Lo vemos en una animación :
A) ENLACE IÓNICO
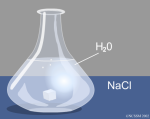
El enlace iónico se produce entre átomos de elementos metálicos y átomos de elementos no metálicos. Mira la siguiente simulación de la formación del cloruro de sodio. También puedes verlo aquí y en el siguiente vídeo:
Debes conocer las principales propiedades de las sutancias iónicas. Mira cómo se produce la disolución de una sal en agua:
B) ENLACE COVALENTE.
Veamos ahora como se unen los átomos ( de dos no metales) mediante enlace covalente:
Observa como es la estructura de Lewis para la molécula de cloro.
Aquí tienes las propiedades de las sustancias covalentes.
Prueba ahora a enlazar los átomos que aparecen en la siguiente tabla periódica:
C) ENLACE METÁLICO
Recuerda lo fundamental del enlace metálico:
Debes conocer las propiedades físicas de las sustancias según el enlace.
Por último, no viene mal este repaso , y responder a estas cuestiones antes de autoevaluarte.
Las sustancias a las que dan lugar las diferentes uniones entre átomos pueden ser simples o compuestas. Recordemos del curso pasado que una sustancia simple es una sustancia pura formada por un solo tipo de átomos y que no se puede descomponer en otras diferentes por ningún proceso químico. Mira el siguiente video:
Lo habitual es que átomos de diferentes elementos se combinen entre sí, dando lugar a la gran diversidad de compuestos que se conocen.
Un compuesto es una sustancia pura formada por varios tipos de átomos, a partir de la que podemos obtener otras por procesos químicos.
La proporción de los átomos en un compuesto se expresa mediante una fórmula. Si el compuesto está formado por moléculas independientes, la fórmula nos indica qué átomos forman la molécula y en qué número. Si es una red iónica, la fórmula indica la proporción entre los átomos de cada clase.
MASAS ATÓMICAS Y MOLECULARES.
Antes de nada deberías hacerte una idea acerca del tamaño de los átomos. El valor de masa atómica de los elementos que se informa en la tabla periódica es un promedio de las masas de todos los isótopos estables del elemento ponderado por su abundancia natural :
..
Prueba a construir moléculas de algunos compuestos comunes:
La masa molecular es la masa de una molécula, expresada en unidades de masa atómica (u). Se calcula sumando las masas atómicas de los átomos que componen la molécula :
enlace 1 , enlace 2 y enlace 3
CONCEPTO DE MOL
Una de las unidades más utilizadas y más importante en Química es el mol